Licence SV - 3ème année (L3)
Structure L3 Sciences de la Vie
SEMESTRE 5
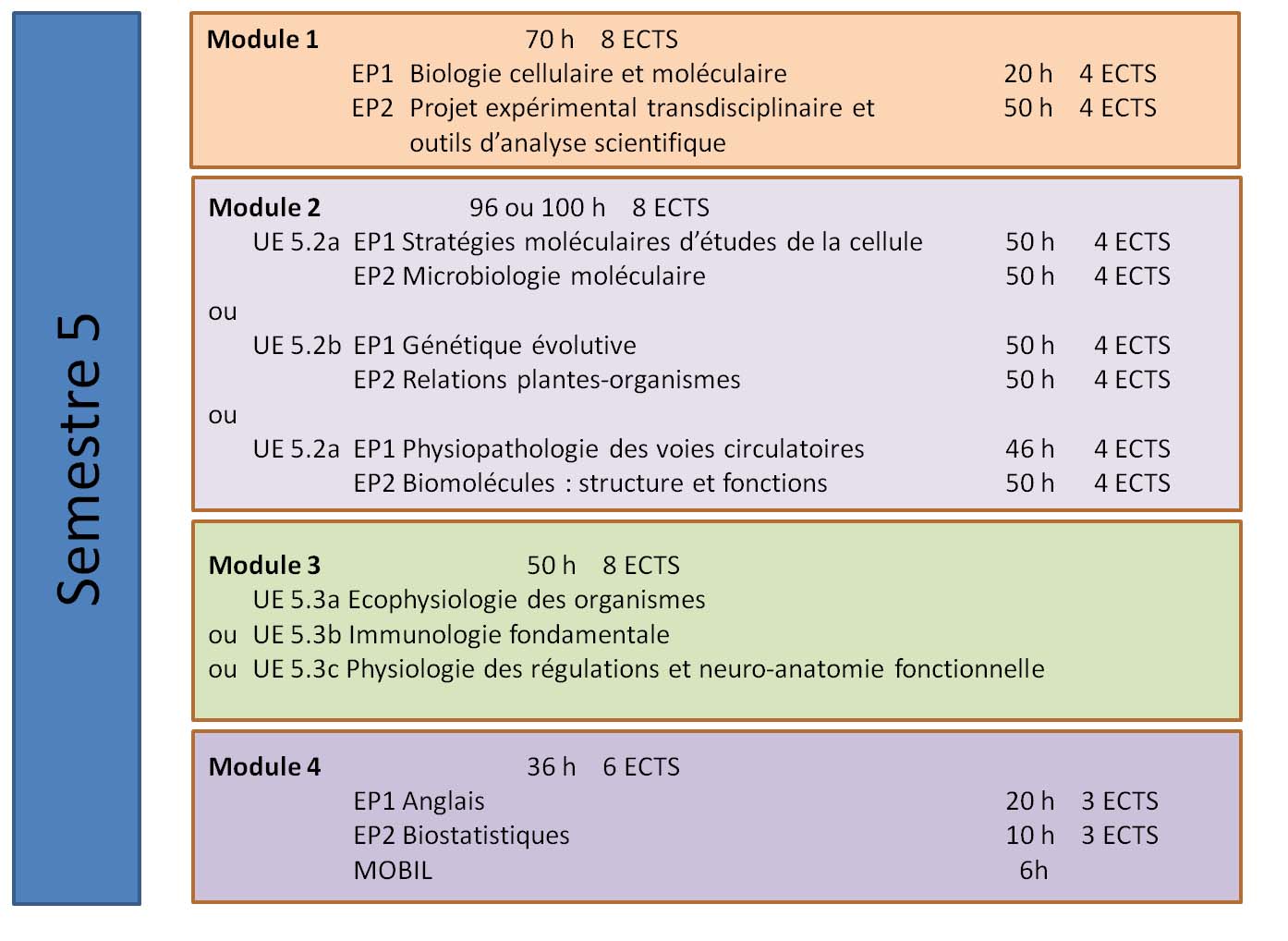
Module 1
SV5.1 EP1 Biologie cellulaire et moléculaire
CM : 14h – TD : 6h
Cours : Acides nucléiques et éléments de génomique - Enzymes et techniques relatives aux acides nucléiques - Chromosomes, réplication et cycle cellulaire - Réponses aux lésions du génome - Transcription et régulation de l'expression génique. Le fil conducteur de cet enseignement réside dans la description des modifications épigénétiques et celle de leur implication dans le fonctionnement cellulaire. Le cours s’appuie sur des exemples concrets issus d’articles scientifiques qui illustrent la mise en place de la démarche scientifique.
TD : Compréhension du principe et des champs d’application des techniques employées, de l’interprétation des résultats et de leur validation (témoins, contrôles, …) à partir d’exemples issus de la littérature scientifique - Analyse d'article scientifique, mise à disposition et corrections des annales des années antérieures. Cet EP tendra à mettre en œuvre un système d’auto-évaluation du niveau et d’accompagnement des étudiants.
SV5.1 EP2 Projet expérimental transdisciplinaire et outils d’analyse scientifiques
CM : 1h - TD : 14h - TP : 35h
Cours : Présentation générale du modèle d’étude et identification de problématiques scientifiques associées. Cette EP a pour but de sensibiliser les étudiants aux moyens de traiter une question biologique par la mise en œuvre de méthodologies expérimentales faisant appel à plusieurs champs disciplinaires.
TD : Outils à mettre en œuvre pour répondre à une question scientifique - Données pratiques à prendre en compte (calculs de dilution, molarité, dilution sérielle…) - Présentation de résultats à l’identique d’une publication : droite étalon, histogrammes, résultats de gel - Méthodes d’analyse de résultats dans une démarche scientifique et rédaction d’un compte-rendu.
TP : L’organisation de ce TP se fait sur la base de 16-18 étudiants par groupe encadrés par un enseignant - Le TP s’effectue sur une semaine en continu afin de mettre les étudiants en situation de mener et contrôler leur projet scientifique, de l’élaboration à l’analyse des résultats.
Pré-requis : Avoir validé 90 ECTS et acquis des notions en biologie cellulaire et moléculaire, biochimie et microbiologie. Avoir des connaissances pratiques en expérimentation - Avoir des notions d’analyse de résultats scientifiques.
Module 2
SV5.2a EP1 Stratégies Moléculaires d’Etude de la Cellule
CM : 24h - TD : 18h - TP : 8h
Cours : Introduction à la Planification et la gestion de la recherche - Conceptualisation, mise en place d’un projet expérimental - Technologies d’analyse de l’ADN (hybridation, PCR, séquencage, bio-informatique) - Stratégies d’analyse moléculaire utilisant l’ADN (marqueurs moléculaires, clonage, base de données, empreintes génétiques, marqueurs épigénétiques) et de la modification des génomes (RNAi, CRISPR-Cas9) - Protocoles expérimentaux pour l’étude de la production et la détection d’ARN - Le monde des petits ARN application aux cancers - Protocoles expérimentaux pour l’étude de la production et la détection des protéines - Etude des interactions acides nucléiques/protéines - Biotechnologie, Thérapie cellulaire et génique.
TD : Analyse de résultats expérimentaux et analyse d’articles en anglais illustrant les notions développées en cours - Rédaction d’une revue scientifique sur un point technologique innovant - Construction d’un projet de recherche, rédaction d’un résumé vulgarisé - Exposé oral suivant le nombre d’étudiant.
TP : Mise en place et réalisation d’un plan expérimental pour l’analyse de l’expression d’un gène en utilisant les outils de bio-informatique.
Pré-requis : Avoir validé 80 ECTS et acquis de bonnes compétences en biologie cellulaire et moléculaire, en génétique et en biochimie ainsi qu’en méthodologie liée à ces trois domaines (niveau utilisation) = EP de Biologie cellulaire (I & II), de Biologie moléculaire, de Génétique moléculaire (I & II), et de Biochimie (I) de l’Université de Tours - Cette UE nécessite une curiosité intellectuelle, une aptitude à se documenter en français et en anglais, une capacité à communiquer à l’écrit et à l’oral.
SV 5.2a EP2 Microbiologie moléculaire
CM : 28h - TD : 14h - TP : 8h
CM Bactériologie : Organisation du génome des procaryotes ; particularités - Plasmides, éléments génétiques mobiles - Cytosquelette - Variations, mutations. CM Virologie : Génomique virale comparée - Quasi-espèces - Mécanismes transcriptionnels et post-transcriptionnels particuliers aux virus. - Régulation post-transcriptionnelle des gènes viraux (épissage, miR, editing, etc…) - Détournement de la machine traductionnelle par les virus - Implication de ces mécanismes dans le shut off de la cellule infectée. CM Parasitologie : Génomique fonctionnelle - Mécanismes impliqués dans la variation antigénique (épigénétique, régulation de la transcription, modification de l’ARN…).
TD : Applications du cours sous forme d'exercices - Présentation d'articles.
TP : CMI/CMB - Sélection de mutants - Conjugaison bactérienne
Pré-requis : Avoir suivi un enseignement de microbiologie générale et de génétique et/ou de biologie moléculaire.
SV5.2b EP1 Génétique évolutive
CM : 26h - TD : 16h - TP : 8h
Cours : Introduction : Les preuves de l’évolution - Histoire de la théorie de l’évolution et de la génétique des populations et de ses applications en agronomie, santé humaine, écologie et biologie de la conservation. Partie 1 : Diversité et structure génétique d’une population - Variabilité génétique et polymorphisme : origine, caractérisation (marqueurs moléculaires) et conséquences phénotypiques - Structure génétique d’une population idéale théorique (le modèle de Hardy-Weinberg). - Les régimes de reproduction : définitions et impacts sur la structure génétique des populations. Partie 2 : Les forces et mécanismes de l’évolution - Les forces évolutives : mutation, migration, dérive génétique et sélection naturelle - Les mécanismes de l’adaptation : contraintes et limites - La théorie de l’évolution neutre et l’évolution moléculaire.
TD : Application et approfondissement des principales notions de génétique des populations vues en cours par la résolution d’exercices.
TP : Analyse des effets de la mutation, la migration, la sélection naturelle et la dérive génétique sur la diversité, la structure et l’évolution de populations théoriques simulées par ordinateur (logiciels informatiques de génétique des populations).
Pré-requis : Maîtriser des concepts et méthodes en génétique formelle (lois de Mendel) et en génétique moléculaire - Maîtriser des lois de probabilités et des statistiques descriptives.
SV5.2b EP2 Relations Plantes-Organismes
CM : 26h - TD : 16h - TP : 8h
CM, TD : Comprendre au niveau cellulaire, biochimique et moléculaire les processus physiologiques impliqués dans l’adaptation des plantes aux contraintes biotiques de leur environnement : coévolution plantes-animaux (fleur qui ressemble à la femelle d’un insecte polinisateur, …), mécanismes de défense des plantes contre les micro-organismes pathogènes (gènes de résistances, notion de lutte biologique…) et de combat contre les herbivores (attraction des prédateurs,…) - Interactions plantes/organismes vivants : relations bénéfiques (micro-organismes et insectes) et parasitisme (phytopathologie et ravageurs).
TP : Relations compatibles et incompatibles entre plantes et bactéries phytopathogènes : histologie, techniques de biochimie et de biologie moléculaire, analyse de métabolites par des mesures physicochimiques et chimie analytique (GC et CCM).
SV5.2c EP1 Physiopathologie des voies circulatoires
CM : 20h - TD : 10h - TP : 16h
Cours : Détournement de la fonction par les cellules non excitables - Exemples de la physiologie à la pathologie - Circulation lymphatique et pathologies - Circulation coronaire et/ou cérébrale et pathologie (resténose, plaque d’athérome…) - De la vasculogenèse à l’angiogenèse - Le sang et les pathologies.
TD : Exercices sur les méthodes d’étude en physiologie cardiovasculaire - Etude de cas pathologique - Simulation informatique - Exercices ouvrant une réflexion sur la physiologie et transposable à d’autres phénomènes biologiques.
TP : Mesure des résistances transendothéliales et activité contractile du muscle lisse vasculaire.
SV5.2c EP2 Biomolécules : structures et fonctions
CM : 28h - TD : 14h - TP : 8h
Cours : Structure et fonction des protéines: les différents niveaux d’organisation structurale, relations structure-fonction - Sucres et glycoprotéines: structure et métabolisme des glycoconjugués, sucres et reconnaissances cellulaires - Lipides et membranes: constituants membranaires et principes de l’organisation membranaire, transports membranaires - Enzymologie générale: Nomenclature et classification, spécificité d'action des enzymes, cinétique des réactions à un substrat, mesure des activités enzymatiques.
TD : Exercices d’application utilisés dans les plusieurs disciplines du vivant portant sur : spectrophotométrie, structure des protéines, techniques biochimiques et tampons, cinétique enzymatique - Exercices permettant d’avoir une meilleure compréhension des phénomènes biologiques au niveau moléculaire.
TP : Purification, caractérisation et étude fonctionnelle d’une enzyme
Pré-requis : Avoir suivi un enseignement en biochimie structurale, en métabolisme et une introduction à l'enzymologie.
Module 3
SV5.3a - Ecophysiologie des organismes
CM : 30h - TD : 12h - TP : 8h
Cours : Organisation et évolution des systèmes sensoriels - Ecologie sensorielle et orientation spatiale - Thermorégulation - Equilibre hydrique et ionique - Adaptations des animaux aux différents milieux (marin, dulcicole, terrestre) - Adaptation des grandes familles végétales à l’environnement (sol, climat) - Phytosociologie.
TD : Révision et approfondissement des concepts en physiologie des organismes animaux et végétaux, en écophysiologie et en écologie sensorielle - Discussion critique de documents et matériel vidéo.
TP : Orientation spatiale, adaptations à la locomotion dans des différents milieux.
SV5.3b - Immunologie fondamentale
CM : 24h - TD : 14h - TP : 12h
Cours : Les organes du système immunitaire - Les acteurs moléculaires et cellulaires impliqués lors des réponses immunitaires innées et adaptatives - La réponse inflammatoire - La présentation antigénique - Les mécanismes de l’immunité anti-infectieuse.
TD : Description des techniques utilisées en immunologie clinique et en recherche fondamentale - Exercices d’application.
TP : Immunoprécipitation d’une molécule de classe I du CMH - Dosage d’une cytokine par ELISA - Observation de cellules immunitaires.
SV 5.3c - Physiologie des régulations humaines et neuro-anatomie fonctionnelle
CM : 26h - TD : 16h - TP : 8h
Cours : Physiologie cardiaque - Physiologie respiratoire - Régulation de la pression artérielle - Régulation hydrique et acido-basique - Anatomie des différents étages du système nerveux central humain (depuis la moelle épinière jusqu’au cortex cérébral) et de ses fonctions de contrôle et de régulation physiologique et sensori-motrice - Etude de cas en neuro-anatomie clinique - Interactions système nerveux somatique et végétatif.
TD : Exercices sur les méthodes d'étude en physiologie - Etude de cas pathologiques.
TP : Mesure des paramètres physiologiques humains : mesure du pouls et de la pression artérielle - spirométrie - Réalisation d’un ECG - Mesure des différents paramètres lors d’un exercice.
Module 4 - Compétences transversales
SV5.4 EP1 Anglais
TD : 20h
SV 5.4 EP2 Biostatistiques
CM : 3h - TD : 3h - TP : 4h
Objectifs pédagogiques : A partir de données récoltées par exemple lors de leurs stages ou lors d’expériences en TP ou de sortie de terrain, les étudiants devront savoir quel test appliquer et comment l’utiliser pour pouvoir répondre à une question posée.
Compétences acquises : Méthodologiques : Choix du test en fonction du type de données que l’on a à traiter (quantitatives, qualitatives, …) et calcul des tests. Techniques : Utilisation du logiciel R comme logiciel de statistique.
Cours : Test du Χ2 - Tests non paramétriques de comparaison de 2 échantillons indépendants : Test des médianes, Mann-Whitney, Kolmogorv-Smirnov.
TD : Applications de ces tests non paramétriques à des jeux de données tels qu’elles peuvent être récoltées lors de stages, d’expériences en TP ou de sortie de terrain.
TP : Choix du test non paramétrique en fonction des données à traiter (quantitatives, qualitatives, …) et calcul à l’aide du logiciel de statistique R.
Pré-requis : Avoir des compétences en statistique descriptive : calcul des variables de position (moyenne, médiane, mode) et des variables de dispersion (variance, coefficient de variation). Avoir des notions en inférence statistique (échantillonnage, estimation).
SV5.4 MOBIL
CM : 2h - TD : 4h
Objectifs pédagogiques : MOBIL est l’acronyme de Module d'Orientation, de Bilan et d'Insertion en Licence. Il est notamment de réfléchir à l’orientation et au projet professionnel et d’avoir une meilleure connaissance des poursuites d’étude après la Licence, des débouchés et du marché du travail. En L3, il est de valoriser les acquis de Licence.
SEMESTRE 6
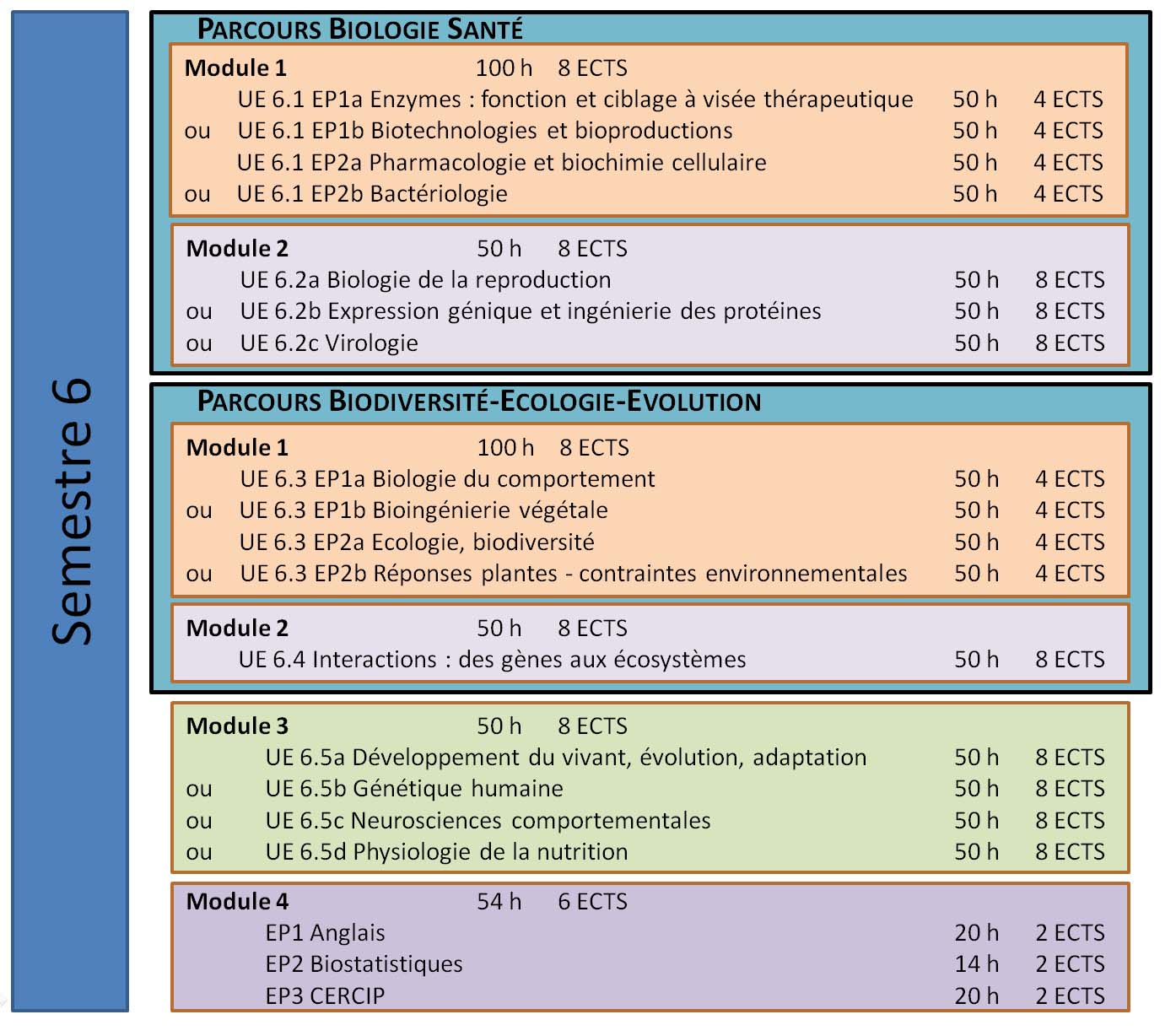
Module 1 Parcours Biologie Santé
SV6.1 EP1a Enzymes : Fonction et ciblage à visée thérapeutique
CM : 24h - TD : 18h - TP : 8h
Cours : Enzymes monomériques et polymériques - Coopérativité et allostérie; conséquences métaboliques - Mécanisme des réactions à deux substrats - Réactions couplées oxydo-réductases, cytochromes et sous-produits de l'oxygène - Métabolisme des dérivés de l’azote et de l'oxygène - Structure et conformation du site actif - Etat de transition et analogues de substrat - Mécanismes de la catalyse enzymatique - Contrôle et régulation de l’activité enzymatique. Vitamines-coenzymes : éléments clés des voies métaboliques, conséquences pathologiques de leur déficit. Métabolisme énergétique de la cellule (phosphorylation oxydative).
TD : Exercices d’application des principaux points traités en cours magistral afin de renforcer les connaissances de base en biochimie par un aspect fondamental mais surtout appliqué via l’utilisation des enzymes en biotechnologies.
TP : Etude d'une enzyme allostérique
Pré-requis : Avoir suivi un enseignement en biochimie structurale, en biochimie métabolique et une introduction à l'enzymologie.
SV6.1 EP1b Biotechnologies et Bioproductions
CM : 26h - TD : 4h - TP : 20h
Cours : Concepts fondamentaux et pratiques liés à l’utilisation des biotechnologies dans la valorisation du vivant depuis la bioproduction de protéines ou de molécules d’intérêt jusqu’au contrôle silencing/surexpression de gènes endogènes ou de transgènes abordés via (1) la transgenèse animale et végétale et modification des génomes ; (2) les biotechnologies blanches ; (3) le génie des procédés.
TD : Réflexions sur le protocole expérimental à développer en TP - interprétation des principaux résultats.
TP : Autour d’une problématique de production de protéines d’intérêt, les étudiants seront amenés à concevoir une approche expérimentale intégrée, depuis la construction moléculaire d’expression, sa création, son transfert dans l’organisme hôte (cellules d’insectes ou plantes) jusqu’à la purification des protéines recombinantes et la caractérisation de leur propriété.
Pré-requis : Avoir validé 90 ECTS - Avoir des compétences en génétique moléculaire et biologie cellulaire - Avoir des notions de métabolisme et de biotechnologies.
SV6.1 EP2a Pharmacologie et biochimie cellulaire
CM : 20h - TD : 14h - TP : 16h
Cours et TD : Par une approche intégrant CM, TD, TP et analyse d’articles, plusieurs thèmes sont abordés : Notion approfondie de réceptologie et ciblage thérapeutique - Approches expérimentales biochimique et pharmacologique du décryptage d’une voie de signalisation : adrénaline et protéines G - Interaction entre les voies de transduction intracellulaire : analyse de la régulation transcriptionnelle (ex des puces à ADN) - Contrôle des voies de signalisation dans l’immunosuppression : la cyclosporine et le rejet des greffes - Les différents types de mort cellulaire : dysfonctionnement des mécanismes de mort cellulaire et pathologies - Analyse des profils métaboliques cellulaires et tissulaires par RMN du 1H, 13C et 31P dans le but d’une approche métabolomique de différentes pathologies.
TP : Identification d’acteurs moléculaires de la voie de transduction de l’adrénaline (récepteurs, protéines G, AMPc) par l’utilisation d’agoniste et d’antagoniste - Mise en évidence et détermination de l’affinité et de la spécificité d’un ligand pour un récepteur. Application aux adrénorécepteurs sur organes isolés.
SV6.1 EP2b Bactériologie
CM : 26h - TD : 14h - TP : 10h
Cours : Identification phénotypique et génotypique des bactéries - Bactérie et santé (biofilm, pathogénicité, facteur de virulence, antibactériens) - Bactérie et agro-alimentaire (réglementation, rôle dans les transformations alimentaires) - Génie microbiologique.
TD : Applications du cours sous forme d'exercices - Présentation d'articles en langue française - Etude de cas clinique pour trouver l’information pertinente, exploiter ses connaissances et développer son analyse.
TP : Identification bactérienne - Synthèse de biofilm.
Pré-requis : Avoir suivi un enseignement de microbiologie générale.
Module 1 Parcours Biodiversité, Ecologie, Evolution
SV6.2 EP1a Biologie du comportement
CM : 22h - TD : 10h - TP : 18h
Cours et TD : Introduction à l’étude du comportement animal - Développement des comportements (ontogénèse) - Stimuli et orientation - Contrôle du comportement, Rythme biologique -Physiologie et neurobiologie du comportement - Communication animale - Régimes d’appariement et soins parentaux - Relations prédateurs- proies : courses aux armements - Organisation sociale, coopération et altruisme - Comportements agressifs et théorie de jeux - Evolution du sexe et sex-ratio biaisé.
TP : 3 séances de TP guidés : étude possible des différents types de comportements tels que les comportements sexuels, sociaux, de dominance, de ponte, etc... chez différentes espèces animales. 3 séances de TP-projet : les étudiants développent et mènent une étude comportementale sur le sujet de leur choix avec rédaction d’un rapport. Ethogramme.
SV6.2 EP1b Bio-ingénierie végétale
CM : 26h - TD : 4h - TP : 20h
Cours : Approches de transgénèse directes et indirectes - transformation stable et transitoire - utilisation des gènes marqueurs et des gènes rapporteurs - plateforme de production végétales (de la cellule à la plante entière) - optimisation de la production - mécanismes physiologiques permettant la remédiation des composés organiques et inorganiques et procédés biotechnologiques. Valorisation des plantes par les approches de « molecularpharming » ou de phytorémédiation.
TD : Discussion autour des « OGM » (organismes actuellement utilisés dans le monde, pays producteurs, législation, traçabilité). Préparation des séances de TP.
TP : Silencing de gènes par la technique du virus-induced gene silencing (VIGS) et modifications métaboliques engendrées - Production de molécules/protéines d’intérêt par transformation transitoire.
Pré-requis : Disposer de 90 crédits ECTS - Connaissances en biologie moléculaire - Notions de biologie végétale.
SV6.2 EP2a Ecologie-Biodiversité
CM : 20h - TD : 10h - TP : 20h
Cours : Thèmes abordés : les principaux paramètres biodémographiques - la modélisation de la croissance d’une population dans différentes situations de développement en temps discret et continu et les interactions entre populations (par exemple : compétition et prédation) - la biologie de la conservation par l’étude de concepts liés à l’utilisation des outils génétiques pour recenser la biodiversité et décrire les interactions biotiques en particulier le "code barre" ADN, le metabarcoding et la génomique environnementale) - l’impact des espèces invasives et de l’anthropisation dont la disparition des habitats naturels.
TD/TP : Utilisation des outils mathématiques et statistiques (utilisation du logiciel R) en biologie des populations, construction et interprétation d’une table de vie. Mise en place de protocoles pour recenser la biodiversité à l’aise d’outils génétiques, utilisation des bases de données génétiques en ligne (BOLD et Genbank), utilisation d’outils informatiques pour l’analyse de données génétiques de type barcode et metabarcode.
Pré-requis : Avoir des notions de génétique de l’évolution (mutations génétiques, transmission héréditaire, sélection naturelle). Avoir des notions de phylogénie (comment lire un arbre phylogénétique, notion d’ancêtre commun).
SV6.2 EP2b Réponses des plantes aux contraintes environnementales
CM : 24h - TD : 10h - TP : 16h
Cours : Physiologie des stress abiotiques et mécanismes de tolérance et d’acclimatation mis en place en réponse à ces contraintes - Perception de la lumière et réponses physiologiques induites - Evolution de la phototrophie et de l’autotrophie carbonée chez les organismes photosynthétiques.
TD : Approfondissement des cours par l’analyse de publications scientifiques.
TP : Etude de la régulation de l’activité phosphoénolpyruvate carboxylase chez une plante à photosynthèse de type C4 via l’extraction de protéines et mesures d’activités enzymatiques,immuno-détection de protéines sur coupes de tissus foliaires ou par western blot sur extraits protéiques totaux ; Analyse des perturbations géniques déclenchées par les stress abiotiques via une analyse bioinformatique de bases de données.
Module 2 Parcours Biologie Santé
SV6.2a Biologie de la reproduction
CM : 26h - TD : 16h - TP : 8h
Cours : La fonction génitale femelle et mâle chez les vertébrés, en particulier chez les mammifères : développement de l’appareil uro-génital, anatomie des voies génitales, gamétogenèse, méiose, physiologie des gonades, endocrinologie et signalisation cellulaire, comportements (sexuel, maternel), facteurs de régulation de la fonction de reproduction (hormones, facteurs environnementaux…) - La fécondation - La gestation et les annexes embryonnaires, la parturition et la lactation - La reproduction chez les insectes.
TD : Présentations et exercices d’applications : outils moléculaires appliqués à la reproduction, brassage génétique, biotechnologies de la reproduction, éthique et législation en expérimentation animale, épigénétique et DOHaD (DevelopmentalOrigins of Health and Diseases). Exposés des étudiants sur des thématiques relatives à la fonction de reproduction.
TP : Les spermatozoïdes : morphologie, motilité et facteurs de régulation - Analyse comparée des tractus génitaux mâles et femelles chez différentes espèces - Histologie des gonades.
SV6.2b Expression génique et ingénierie des protéines
CM : 18h - TD : 14h - TP : 18h
Cours : Introduction, outils et techniques pour séparer, détecter et quantifier les acides nucléiques : 1) Expression génique : quantifier la transcription et étudier sa régulation - mise en évidence le rôle des protéines régulatrices - mesure de la transcription à l’échelle d’une cellule ou d’un tissu. 2) Ingénierie des protéines : clonage ADNc, production des protéines recombinantes et des différents systèmes de production, leurs avantages et inconvénients - Le phage display et ses applications.
TD : Applications des notions abordées en cours pour une assimilation de la démarche expérimentale et du choix pertinent des techniques et pour le développement de l’esprit critique.
TP : Clonage d’une protéine « biomédicament », application en thérapie humaine.
Pré-requis : Avoir suivi un enseignement en biochimie structurale, en biologie moléculaire et en biologie cellulaire et moléculaire.
SV6.2c Virologie
CM : 26h - TD : 12h - TP : 12h
Cours : Historique - Diversité des cycles de multiplication des virus - Mécanismes de contamination des virus des hépatites, herpesvirus, rhabdovirus, filovirus, rotavirus, influenza virus, picornavirus, rétrovirus, mimivirus, papillomavirus, poxvirus et phages.
TD : Applications du cours sous forme de présentation en groupe d'articles donnés en langue anglaise.
TP : Expression d’une protéine recombinante dans un système baculovirus-cellules d’insectes.
Pré-requis : Avoir suivi un enseignement de microbiologie générale et si possible de génétique et/ou de biologie moléculaire et cellulaire.
Module 2 Parcours Biodiversité, Ecologie, Evolution
SV6.4 Interactions : des gènes aux écosystèmes
CM : 26h - TD : 16h - TP : 8h
Cours : Le cours présente les approches de biologie cellulaire et moléculaires qui permettent d’étudier d’un point de vue fonctionnel des interactions entre espèces et entre espèces et leur environnement. Il permet d’aborder les mécanismes d’adaptation des espèces à leur environnement. Le cours est centré sur des exemples issus de l’ensemble du monde vivant et de différents écosystèmes.
TD : Travail en petits groupes sur des articles scientifiques en anglais. Une synthèse des articles sera présentée sous la forme d’un exposé oral lors d’un symposium scientifique organisé par les étudiants. L’objectif est de comprendre la démarche expérimentale mise en œuvre pour répondre à une question scientifique en écologie.
TP : Le TP sera basé sur l’étude d’interactions entre espèces à l’échelle moléculaire. Les étudiants travailleront sur la mise au point du protocole expérimental. L’objectif est d’apprendre à mettre en œuvre un protocole à partir d’une question scientifique.
Pré-requis : Avoir validé 90 ECTS et des compétences en biologie moléculaire et cellulaire, physiologie végétale et animale et écologie.
Module 3
SV6.5a Développement du Vivant, Evolution, Adaptation
CM : 26h - TD : 10h - TP : 14h
Cours : Édification de l'appareil végétatif des plantes, changement de phase et induction florale, organogenèse florale. Origine et évolution des gènes associés à ces processus dans le règne végétal. Mise en place du plan d’organisation et organogenèse chez les animaux. Conservation, diversification et évolution des gènes associés au développement embryonnaire animal. Compréhension des mécanismes génétiques et moléculaires du développement conservé entre les règnes végétal et animal : gènes homéotiques, protéines polycomb, divisions des cellules-souches (méristèmes). Ces aspects seront illustrés à travers l’étude de mutants d’organogenèse et différents exemples d'adaptation développementale au milieu de vie des organismes.
TD : Exercices d’application inspirés de résultats expérimentaux publiés visant à élargir les champs abordés dans la partie cours. Élaboration de synthèses à partir des domaines traités en cours sur les modèles animaux et végétaux.
TP : Analyse de promoteurs organes-spécifiques grâce au suivi in vivo de l’expression de gènes rapporteurs, contrôle hormonal du développement végétatif. Observations de mutants homéotiques chez Arabidopsis et la drosophile.
SV6.5b Génétique humaine
CM : 26h - TD : 16h - TP : 8h
Cours : Maladies héréditaires monogéniques et polygéniques, mitochondriales (analyses de généalogie, caryotypage). Identification de gènes (lod score, déséquilibre de linkage, clonage, analyse de la fonction). Epigénétique. Thérapie génique. Epidémiologie et génétique des populations. Génétique du cancer héréditaire et spontané, évolution de la tumeur, influence environnementale sur la génétique du cancer, stratégies et modèles de la cancérologie. Cellules souches cancéreuses.
TD : Analyse de résultats expérimentaux et analyse d’articles en anglais illustrant les notions développées en cours. Projet de groupe portant soit sur une maladie génétique, soit sur une thématique cancer.
TP : Caractérisation par caryotype et PCR de cellules cancéreuses en culture.
Pré-requis : Avoir validé 80 ECTS et acquis de bonnes compétences en biologie cellulaire et moléculaire, en génétique et en biochimie ainsi qu’en méthodologie liée à ces trois domaines (niveau utilisation) = EP de Biologie cellulaire (I & II), de Biologie moléculaire, de Génétique moléculaire (I & II), et de Biochimie (I) de l’Université de Tours.
SV6.5c Neurosciences comportementale
CM : 24h - TD : 14h - TP : 12h
Cours : Les thèmes s’articulent autour de l’anatomie fonctionnelle du système nerveux, du rôle des structures cérébrales dans l’initiation et l’expression des fonctions mentales et des comportements. Sont abordés les bases neurobiologiques des fonctions cognitives (attention, mémoire & apprentissage) et affectives (émotions, récompense et motivation) ainsi que les bases de la psychoneuropharmacologie,de la neurogénétique et de l’épigénétique.
TD : Approfondissement des thèmes développés en cours, éléments de neuro-imagerie, de neurogénétique et de neuro-pharmacologie, bases moléculaires et cellulaires de la mémoire.
TP : Techniques de mesure des corrélats physiologiques des comportements chez l’Homme (temps de réaction, audiométrie, activité neurovégétative et émotions, illusions d’optique, apprentissage perceptif, apprentissage incident et intentionnel, apprentissage moteur et transfert bilatéral, partage attentionnel, mémoire de travail). Utilisation de logiciels d’enregistrement de paramètres physiologiques (fréquence cardiaque, activité électrodermale, EEG) et d’études du comportement.
SV6.5d Physiologie de la nutrition
CM : 20h - TD : 10h - TP : 20h
Cours : Il vise à la compréhension des mécanismes physiologiques contrôlant et régulant la digestion et le métabolisme : fonction, organisation et contrôle de la digestion, étude et régulation du métabolisme hydro-minéral, phospho-calcique et lipidique.
TD : Exercices sur les méthodes d'étude en physiologie de la nutrition, sur les transports épithéliaux ; étude de cas pathologiques.
TP : Mesure du métabolisme hépatique et musculaire des glucides, protéines et lipides (extractions et dosages). Mesure de l’activité mécanique intestinale.
Module 4 - Compétences transversales
SV6.6 EP1 Anglais
TD : 20h
SV6.6 EP2 Biostatistiques
CM : 3h - TD : 3h - TP : 4h
Cours : Test du Χ2 - Tests non paramétriques de comparaison de 2 échantillons indépendants : Test des médianes, Mann-Whitney, Kolmogorv-Smirnov.
TD : Applications de ces tests non paramétriques à des jeux de données telles que rencontrées lors d’expériences de TP ou de sortie de terrain ou de stages en laboratoire.
TP : Utilisation du logiciel R pour ces tests non paramétriques.
Pré-requis : Avoir des compétences en statistique descriptive : calcul des variables de position (moyenne, médiane, mode) et des variables de dispersion (variance, coefficient de variation). Avoir des notions en inférence statistique (échantillonnage, estimation).
SV6.6 EP3 CERCIP
TD : 20h
Le contenu et les objectifs seront présentés lors de la rentrée ou voir site web université de Tours
